当今世界,知识产权已成为国家核心竞争力的重要体现之一,是本国发展和参与国际竞争的重要手段。药品研发周期长、投资大、风险高,对专利保护的依赖性更强。各国均制订了符合本国的药品专利保护体系,以期保护药品研发者的权益,刺激药品创新的积极性。
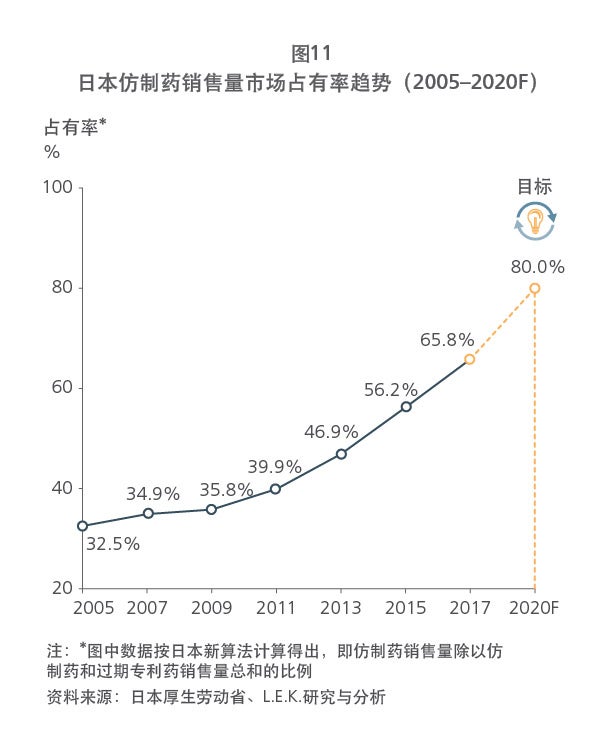
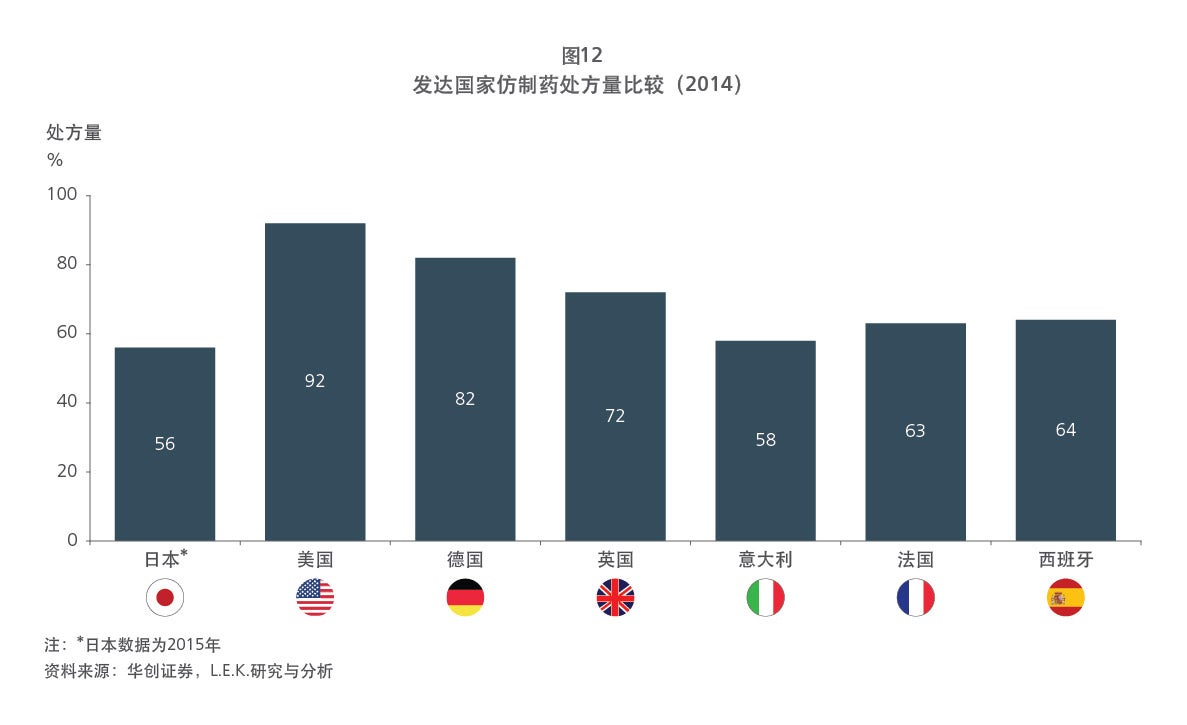
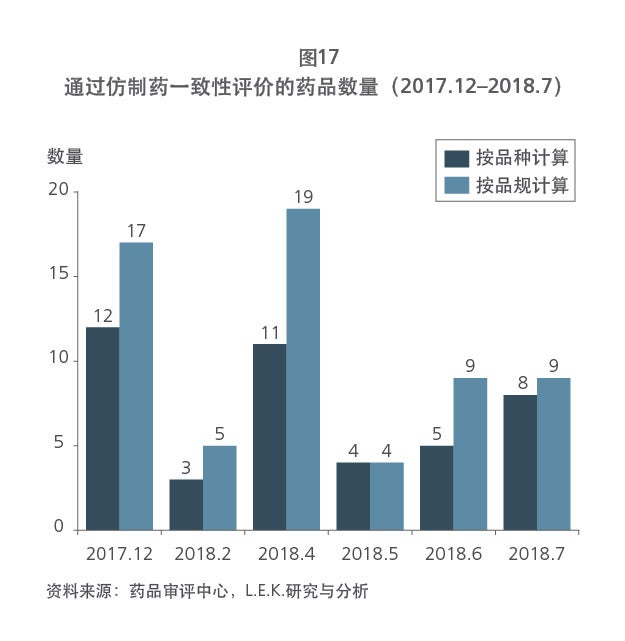
我国是制药大国,仿制药规模庞大,品种数量不断丰富,但仍存在质量参差不齐、同质化现象严重的问题;创新药蓬勃发展,却依旧处于萌芽阶段。为了规范我国制药行业,同时促进创新药和仿制药的平衡发展,近年来,我国推行了一系列的医药卫生改革,逐步完善我国的药品审评审批制度,并实现与国际标准接轨。
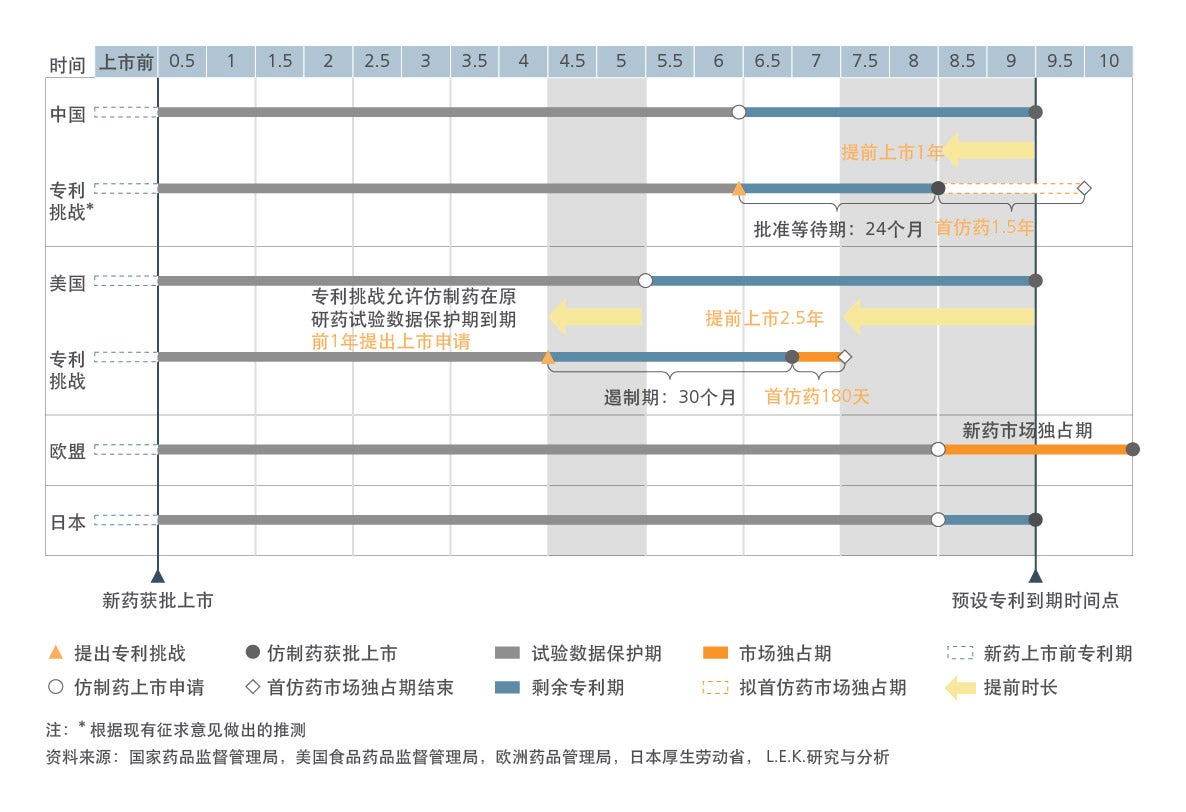
中国政府于2017年、2018年连续发布了三份药品专利保护政策意见征求稿,明确提出了探索建立药品专利链接制度、开展药品专利期限补偿制度试点、完善和落实药品试验数据保护制度等机制在内的药品专利保护体系。这些机制在美国、日本、欧盟等成熟医药市场已有多年的实践经验。其中,药品专利链接制度是美国所独有的亮点机制,在促进美国医药市场仿创平衡发展方面起到了关键作用。学习和了解这些成熟市场经验,有助于更好地建立我国的药品专利保护体系。
基于以上背景,中国医药创新促进会与L.E.K.联合编写了《保护创新、促进仿制——对中国建立药品专利保护体系的政策建议》报告。报告从全球药品专利保护现状及全球药品知识产权保护体系出发,分别剖析了美国、日本、欧盟的药品专利保护体系及亮点制度,并对我国当前药品市场的现状及药品专利保护发展历程进行了回顾与分析,最后,通过对比中国、美国、日本、欧盟的主要药品专利机制,以期为我国未来药品专利保护体系的建立提出政策性参考建议。
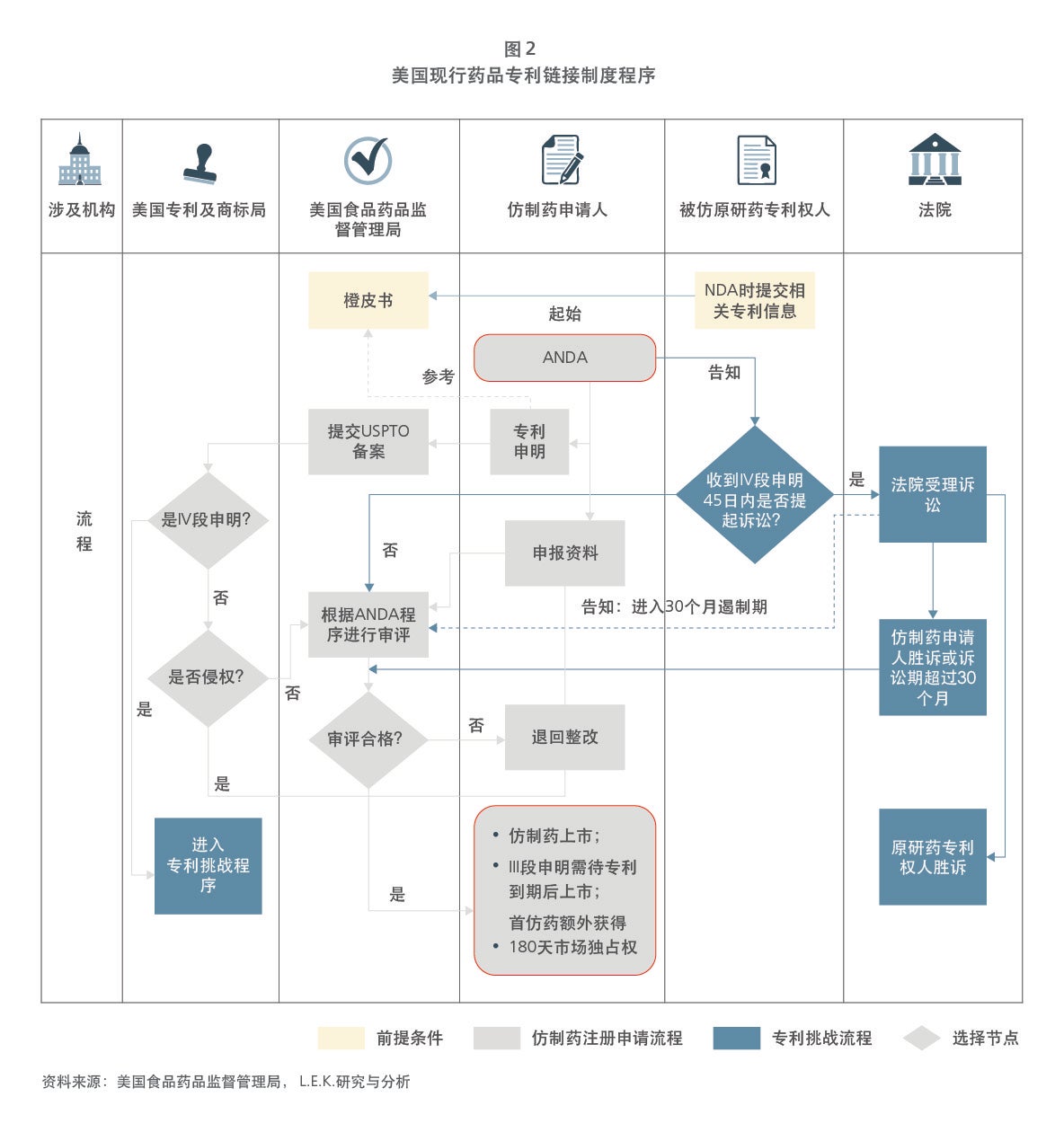
美国是全球最大的医药市场,具有成熟的医药卫生政策体系,早在1984年就开创性地建立了以药品专利链接、试验数据保护、专利期延长等为核心的一套完整的药品专利保护体系。本文详细叙述了美国药品专利保护体系的发展背景,以及药品专利链接制度的完整操作模式、运作原理及市场意义,并通过多个实例,让读者能更生动的了解其机制的核心和影响。
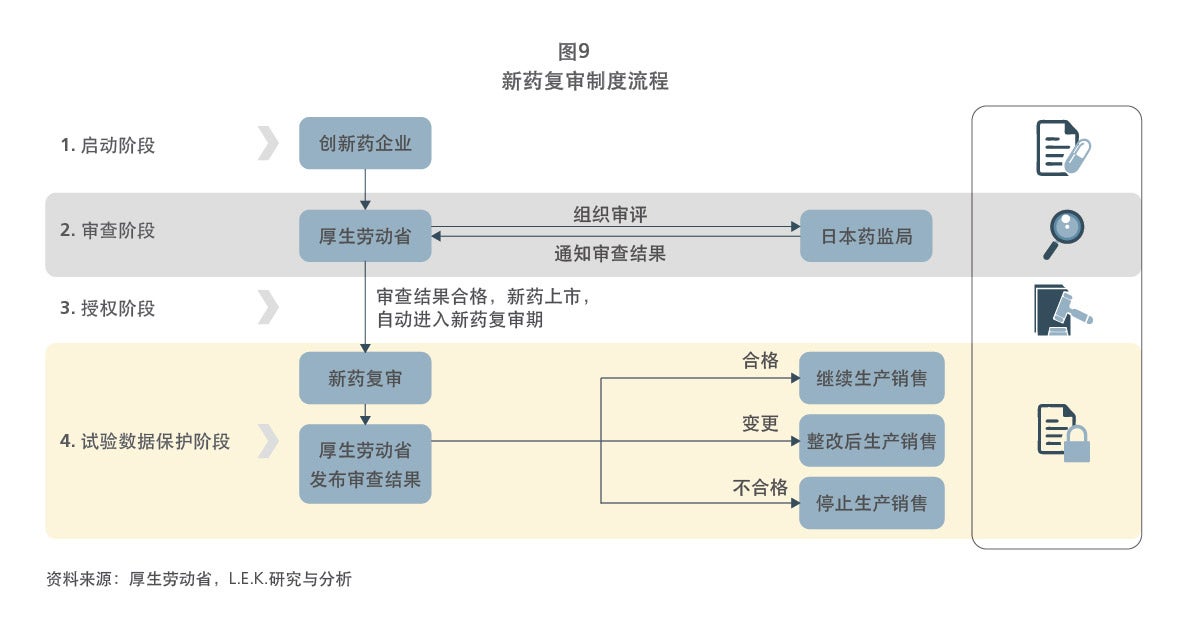
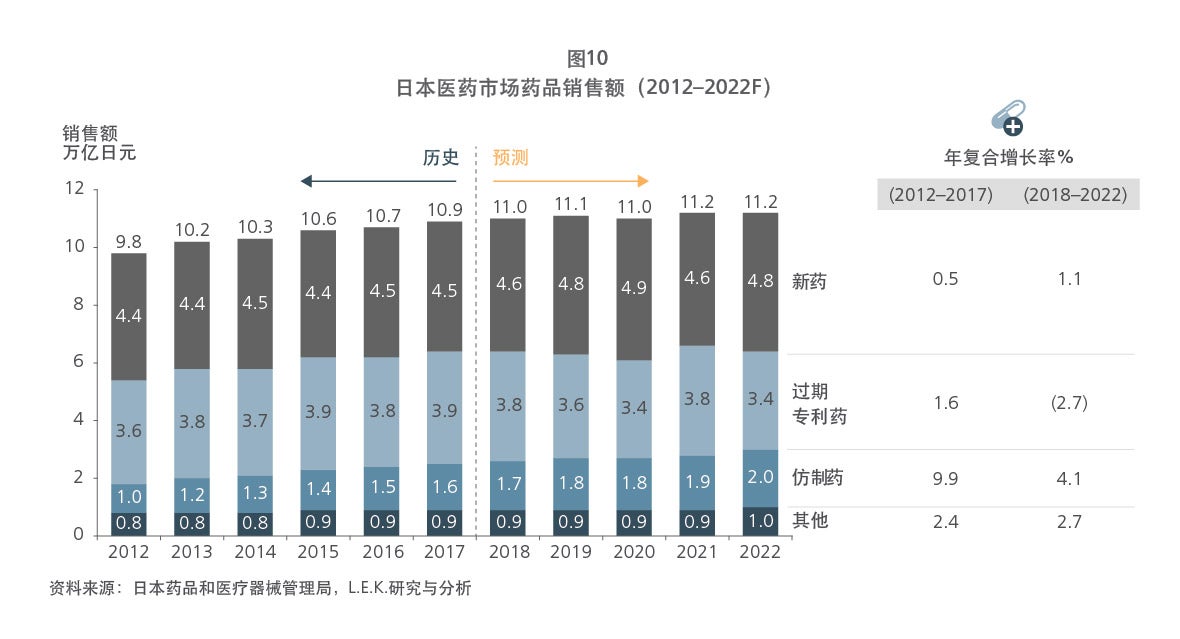
日本和欧盟作为全球医药产业发展成熟的另外两大国家和地区,在药品专利保护体系的建立上也有其特点及优势,日本和欧盟都建立了试验数据保护制度(日本叫新药复审制度)和专利期延长制度(欧盟叫补充保护证书制度),并利用专利诉讼和诉前禁令来解决药品专利纠纷案件。然而,两者均未建立药品专利链接制度,本报告也从行业需求到历史文化等多方面对其背后的原因进行了探析。
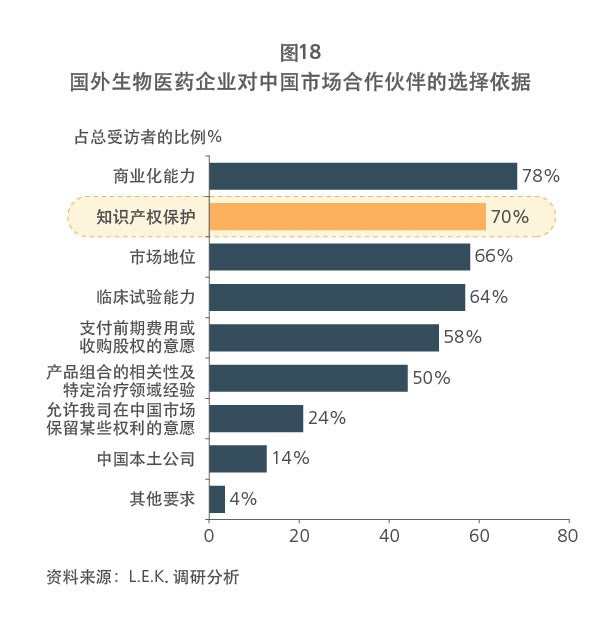
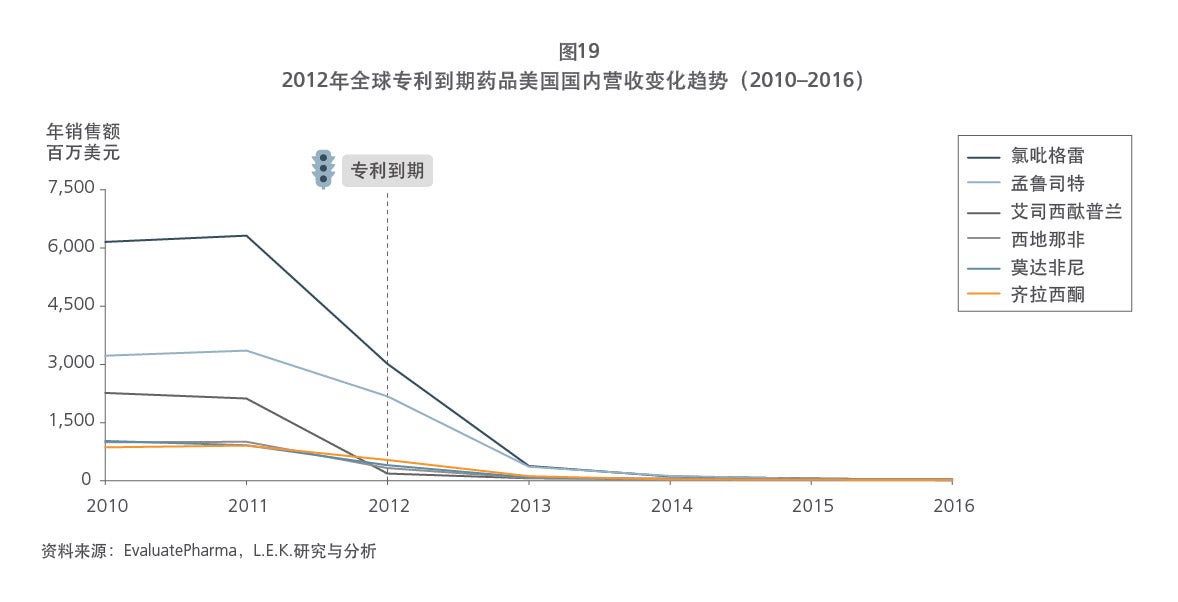
通过对成熟医药市场药品专利保护体系的详解,以及对我国市场现状的分析,本报告指出,现阶段,中国有必要从具体层面出发,考虑搭建药品专利保护体系的系统政策框架及实施细则。这将有助于推动中国整体药品研发和临床试验水平的提高、促进中国创新药与仿制药的平衡发展与进步、提高中国病患的药品可及性和支付水平,同时节省国家医保基金支出。
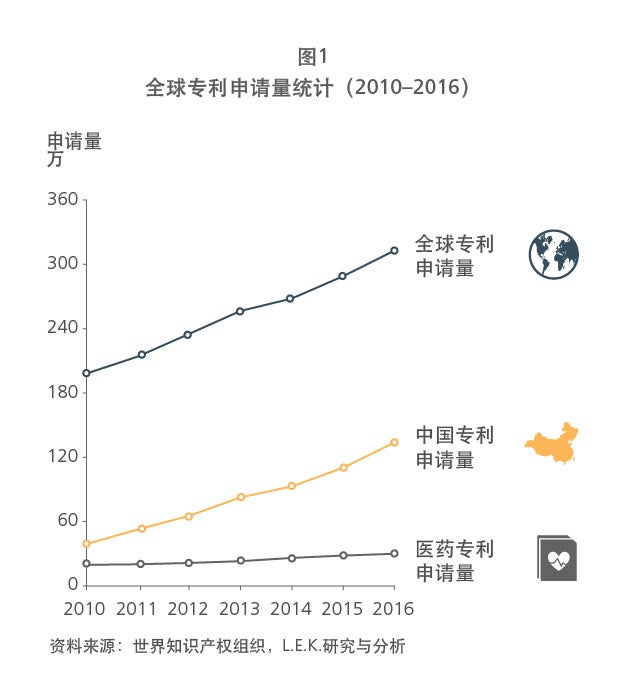
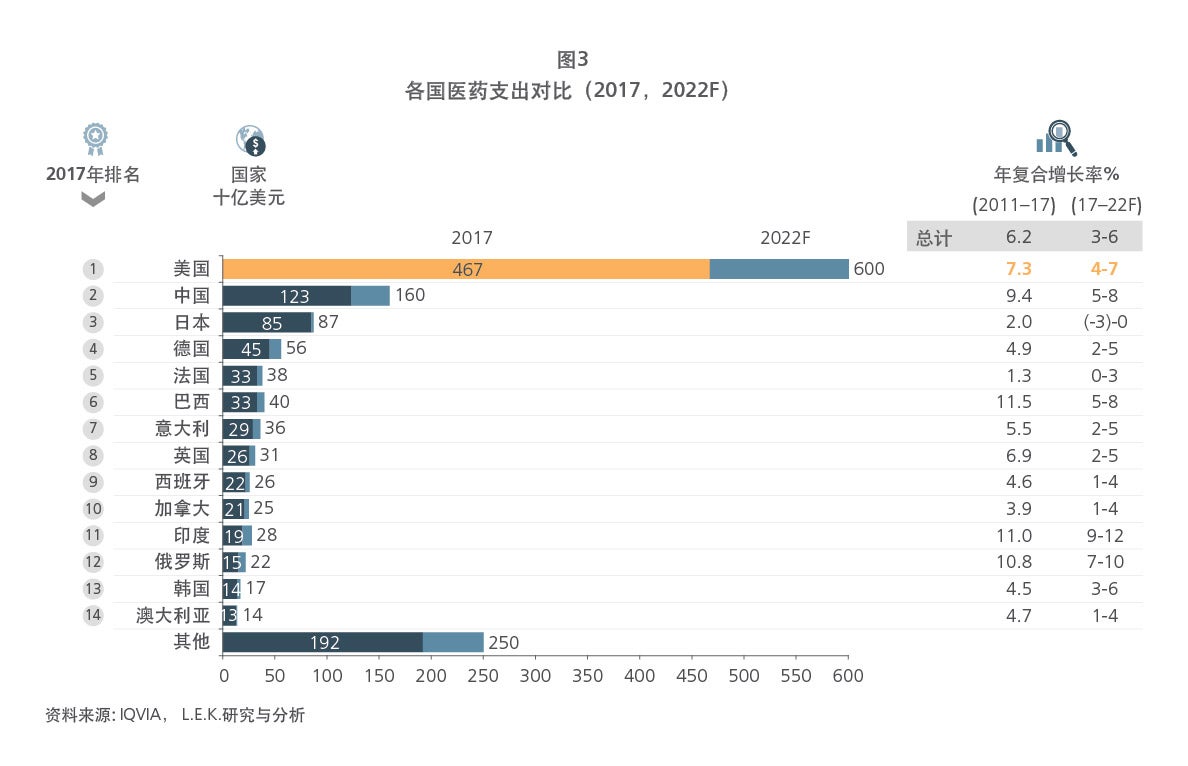
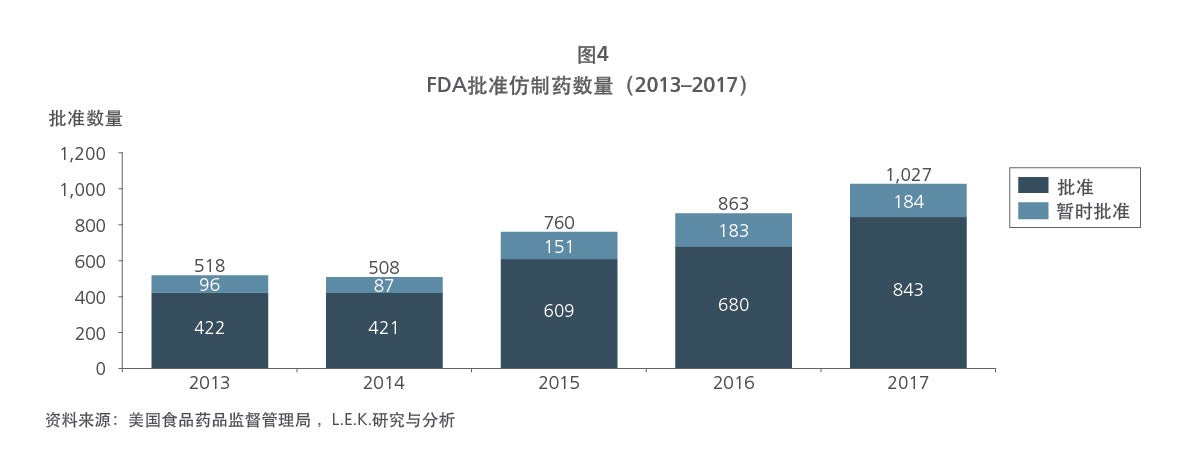
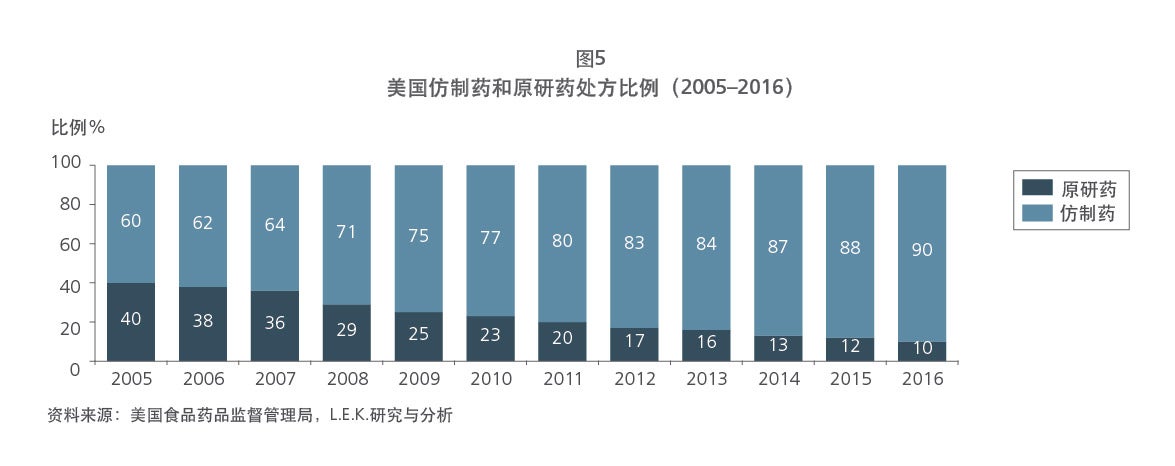
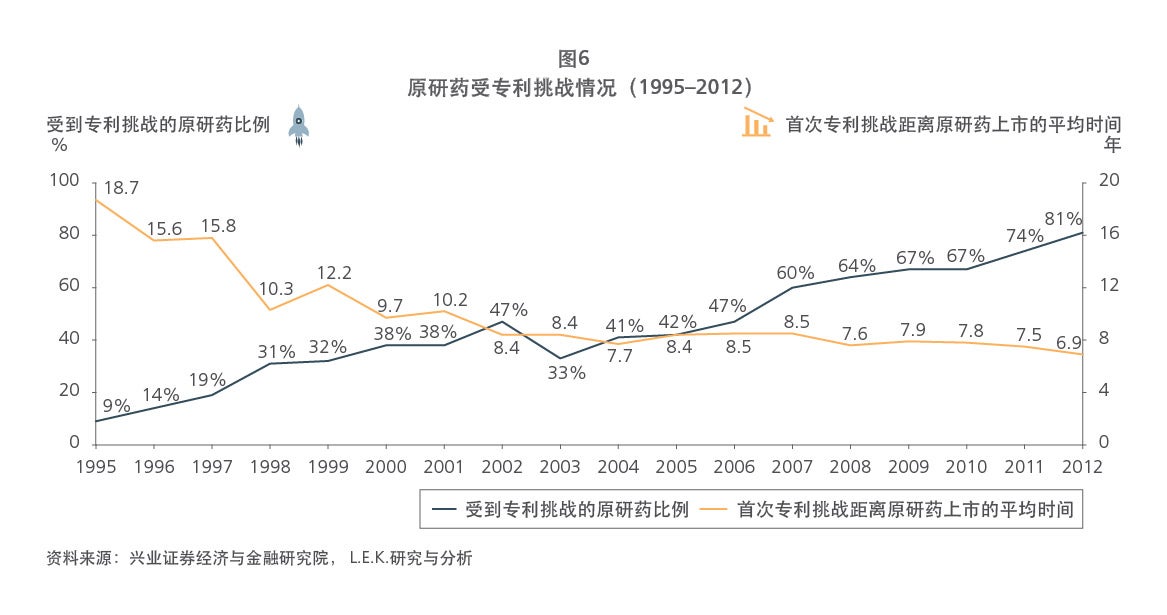
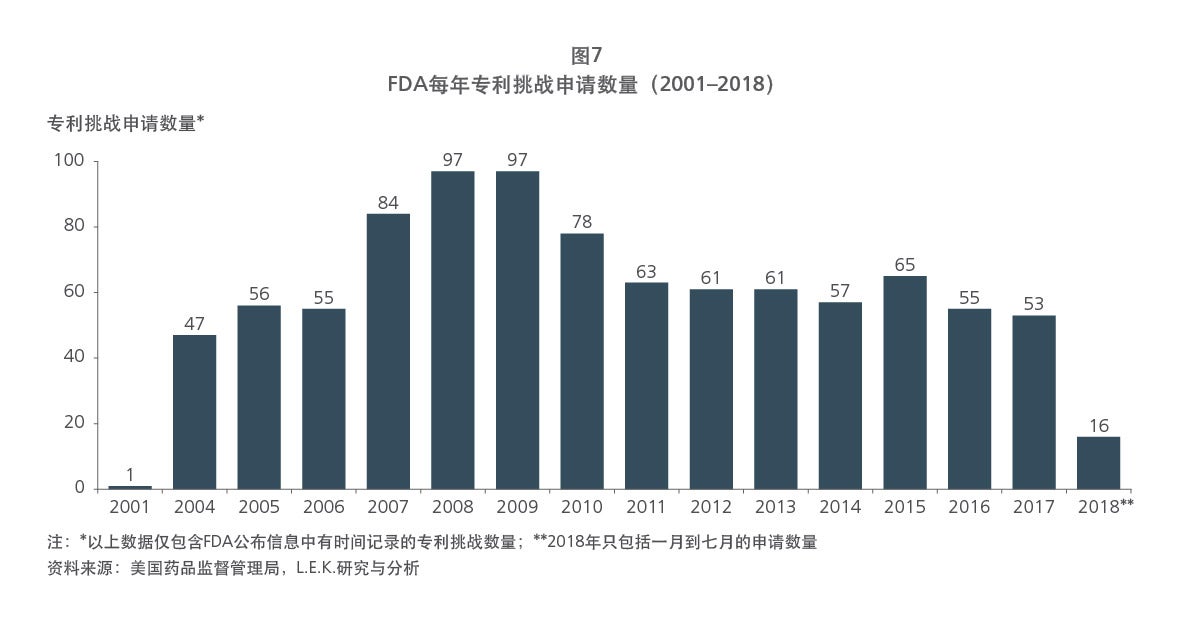
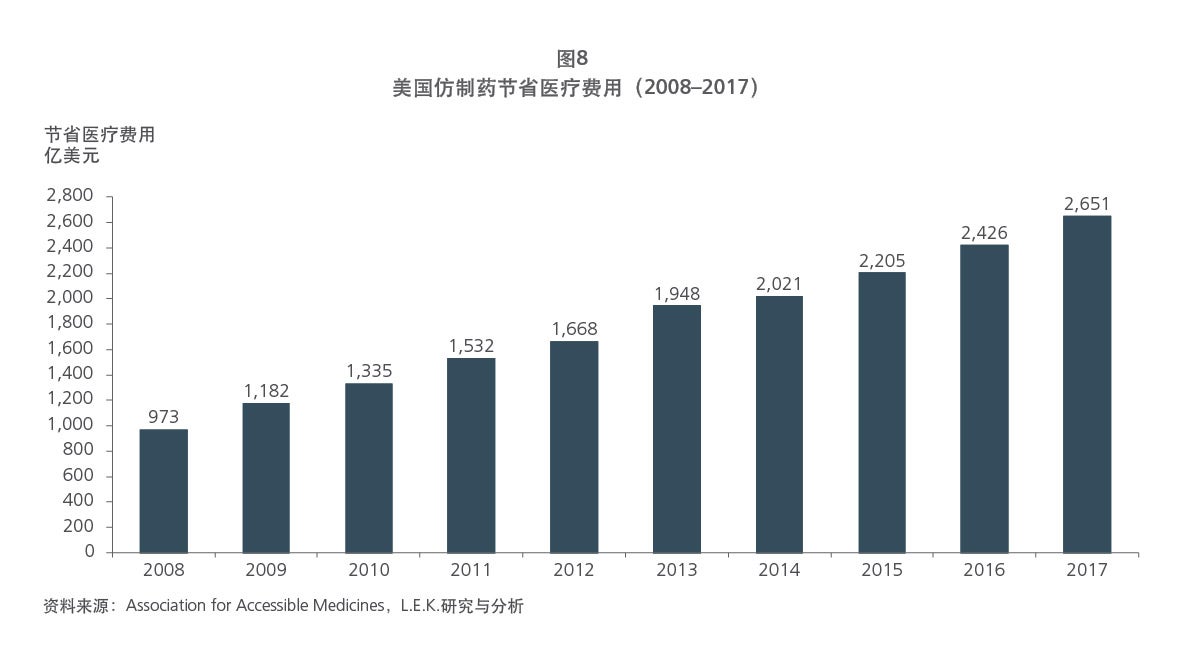
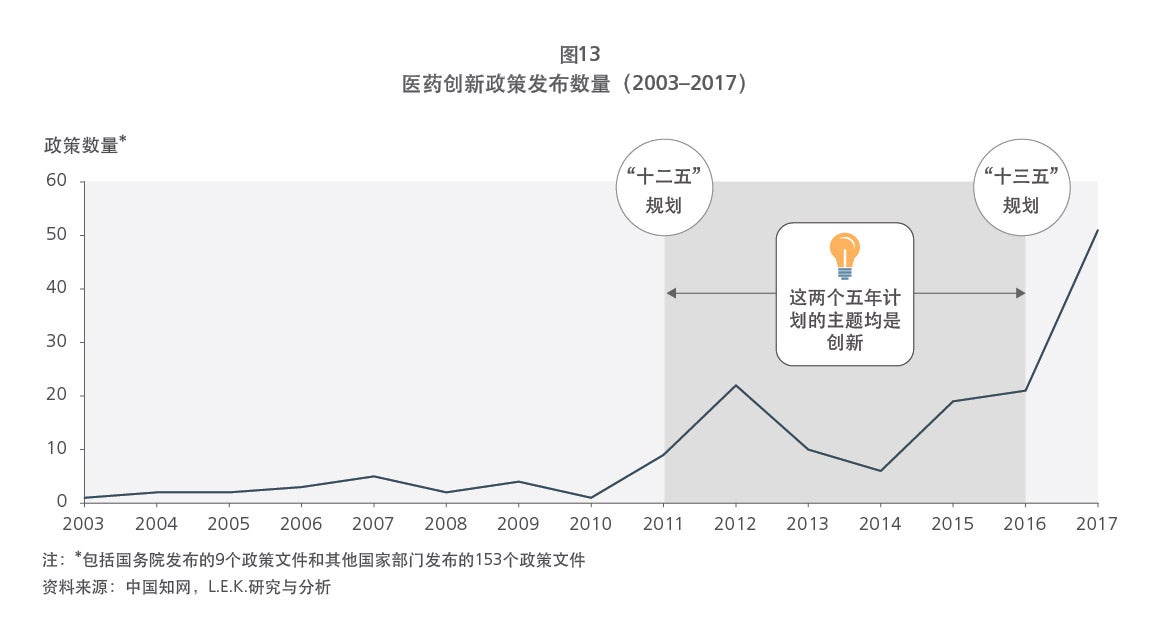
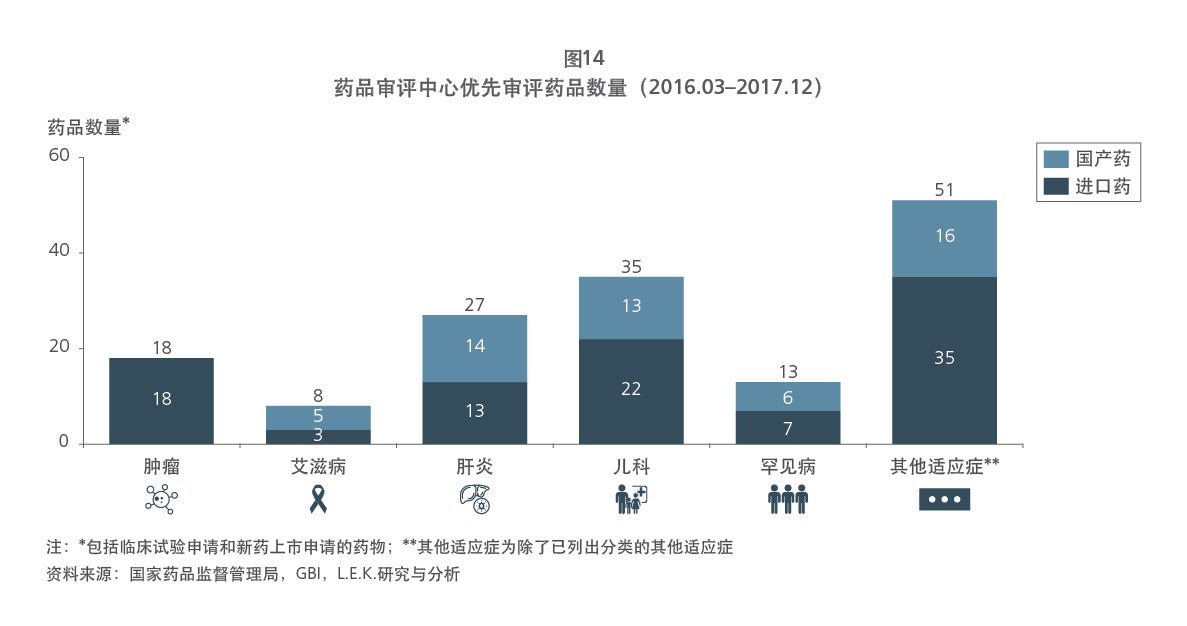
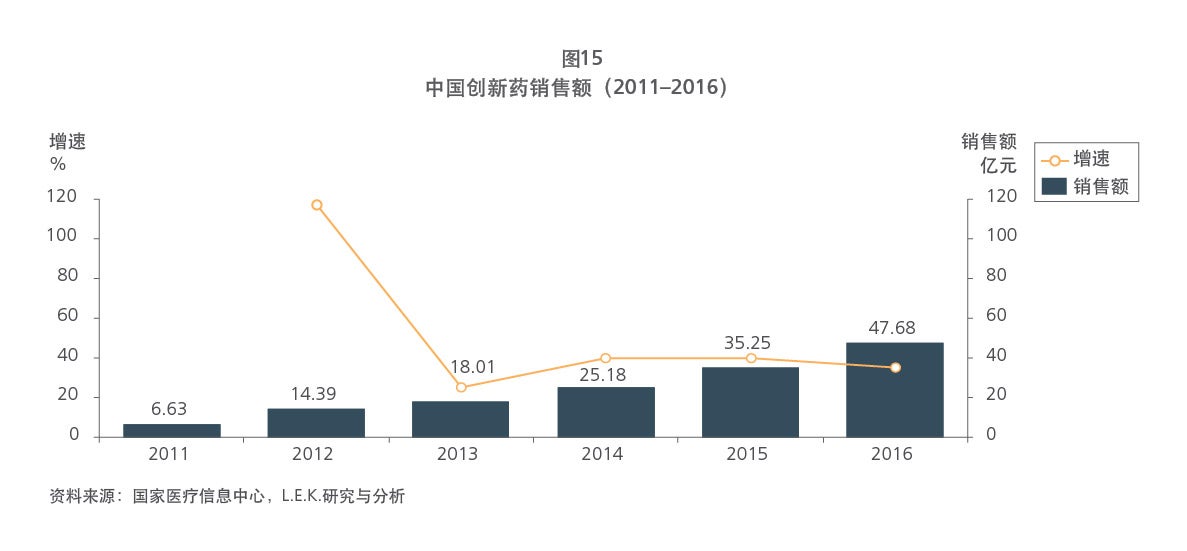
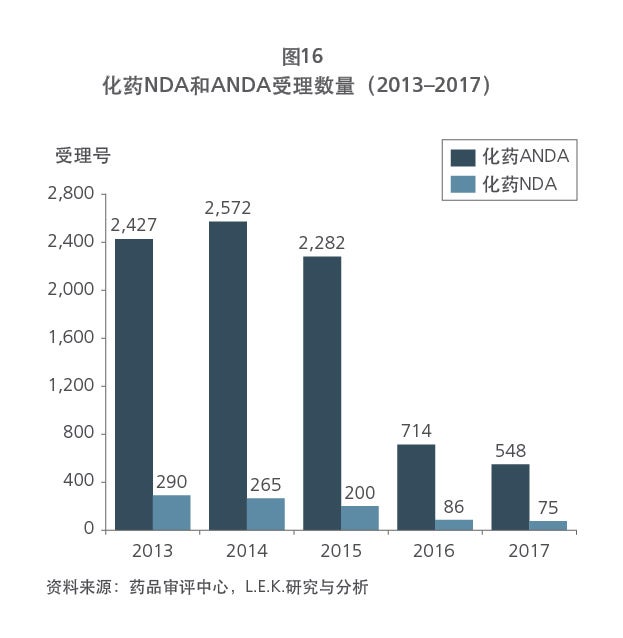
Sample Visuals
07222021100720